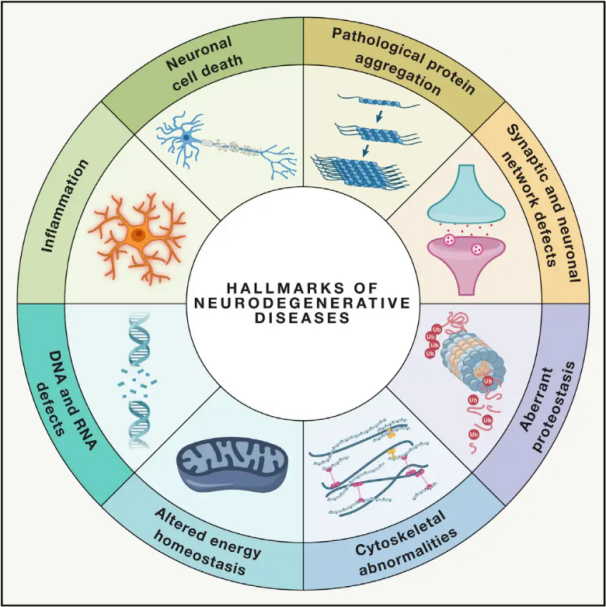
Nevrodegenerativne bolezniZa nevrodegenerativne motnje (NDD) je značilna progresivna ali vztrajna izguba specifičnih ranljivih nevronskih populacij v možganih ali hrbtenjači. Klasifikacija NDD lahko temelji na različnih merilih, vključno z anatomsko porazdelitvijo nevrodegeneracije (kot so ekstrapiramidne motnje, frontotemporalna degeneracija ali spinocerebelarna ataksija), primarnimi molekularnimi nepravilnostmi (kot so amiloid-β, prioni, tau ali α-sinuklein) ali glavnimi kliničnimi značilnostmi (kot so Parkinsonova bolezen, amiotrofična lateralna skleroza in demenca). Kljub tem razlikam v klasifikaciji in predstavitvi simptomov imajo motnje, kot so Parkinsonova bolezen (PB), amiotrofična lateralna skleroza (ALS) in Alzheimerjeva bolezen (AD), skupne osnovne procese, ki vodijo do nevronske disfunkcije in končne celične smrti.
Svetovna zdravstvena organizacija ocenjuje, da bodo zaradi nevrodegenerativnih motenj po vsem svetu milijoni ljudi do leta 2040 te bolezni postale drugi najpogostejši vzrok smrti v razvitih državah. Čeprav obstajajo različna zdravljenja za lajšanje in obvladovanje simptomov, povezanih s specifičnimi boleznimi, ostajajo učinkovite metode za upočasnitev ali ozdravitev napredovanja teh stanj nedosegljive. Nedavne študije kažejo na premik v paradigmah zdravljenja od zgolj simptomatskega obvladovanja k uporabi mehanizmov za zaščito celic za preprečevanje nadaljnjega poslabšanja. Obsežni dokazi kažejo, da imata oksidativni stres in vnetje ključno vlogo pri nevrodegeneraciji, zaradi česar sta ta mehanizma kritična tarča za celično zaščito. V zadnjih letih so temeljne in klinične raziskave razkrile potencial hiperbarične kisikove terapije (HBOT) pri zdravljenju nevrodegenerativnih bolezni.
Razumevanje hiperbarične kisikove terapije (HBOT)
HBOT običajno vključuje povečanje tlaka nad 1 absolutno atmosfero (ATA) – tlak na morski gladini – za 90–120 minut, kar pogosto zahteva več sej, odvisno od specifičnega stanja, ki ga zdravimo. Povečan zračni tlak izboljša dovajanje kisika v celice, kar posledično spodbuja proliferacijo matičnih celic in pospešuje procese celjenja, ki jih posredujejo določeni rastni faktorji.
Prvotno je bila uporaba HBOT utemeljena na Boyle-Marriott-ovem zakonu, ki predpostavlja od tlaka odvisno zmanjšanje plinskih mehurčkov, poleg koristi visokih ravni kisika v tkivih. Obstaja vrsta patologij, za katere je znano, da imajo koristi od hiperoksičnega stanja, ki ga povzroča HBOT, vključno z nekrotičnimi tkivi, poškodbami zaradi sevanja, travmami, opeklinami, kompartmentskim sindromom in plinsko gangreno, med drugim, ki jih je navedlo Podmorsko in hiperbarično medicinsko društvo. Omeniti velja, da se je HBOT izkazal tudi za učinkovito kot dodatno zdravljenje pri različnih modelih vnetnih ali infekcijskih bolezni, kot sta kolitis in sepsa. Zaradi svojih protivnetnih in oksidativnih mehanizmov ponuja HBOT pomemben potencial kot terapevtska pot za nevrodegenerativne bolezni.
Predklinične študije hiperbarične kisikove terapije pri nevrodegenerativnih boleznih: vpogledi v mišji model 3×Tg
Ena od odmevnih študijOsredotočili so se na mišji model Alzheimerjeve bolezni (AD) pri 3×Tg, ki je pokazal terapevtski potencial HBOT pri izboljšanju kognitivnih primanjkljajev. V raziskavo so vključili 17 mesecev stare samce miši 3×Tg v primerjavi s 14 mesecev starimi samci miši C57BL/6, ki so služili kot kontrolna skupina. Študija je pokazala, da HBOT ni le izboljšal kognitivne funkcije, temveč je tudi znatno zmanjšal vnetje, količino plakov in fosforilacijo tau proteina – ključni proces, povezan s patologijo AD.
Zaščitni učinki HBOT so bili pripisani zmanjšanju nevroinflamacije. To se je pokazalo v zmanjšanju proliferacije mikroglije, astroglioze in izločanja provnetnih citokinov. Te ugotovitve poudarjajo dvojno vlogo HBOT pri izboljšanju kognitivnih sposobnosti in hkratnem blaženju nevroinflamatornih procesov, povezanih z Alzheimerjevo boleznijo.
V drugem predkliničnem modelu so za oceno zaščitnih mehanizmov HBOT na nevronsko delovanje in motorične sposobnosti uporabili miši z 1-metil-4-fenil-1,2,3,6-tetrahidropiridin (MPTP). Rezultati so pokazali, da je HBOT pri teh miših prispeval k povečani motorični aktivnosti in moči oprijema, kar je povezano s povečanjem signalizacije mitohondrijske biogeneze, zlasti z aktivacijo SIRT-1, PGC-1α in TFAM. To poudarja pomembno vlogo mitohondrijske funkcije pri nevroprotektivnih učinkih HBOT.
Mehanizmi HBOT pri nevrodegenerativnih boleznih
Temeljno načelo uporabe HBOT za nevrodegenerativne motnje (NDM) leži v povezavi med zmanjšano oskrbo s kisikom in dovzetnostjo za nevrodegenerativne spremembe. Hipoksično inducibilni faktor-1 (HIF-1) ima osrednjo vlogo kot transkripcijski faktor, ki omogoča celično prilagoditev nizki napetosti kisika in je bil vpleten v različne NDD, vključno z Alzheimerjevo boleznijo, Parkinsonovo boleznijo, Huntingtonovo boleznijo in ALS, zaradi česar je ključna tarča zdravil.
Ker je starost pomemben dejavnik tveganja za številne nevrodegenerativne motnje, je raziskovanje vpliva HBOT na nevrobiologijo staranja ključnega pomena. Študije so pokazale, da lahko HBOT izboljša s starostjo povezane kognitivne primanjkljaje pri zdravih starejših osebah.Poleg tega so starejši bolniki s pomembnimi okvarami spomina po izpostavljenosti HBOT pokazali kognitivne izboljšave in povečan možganski pretok krvi.
1. Vpliv HBOT na vnetje in oksidativni stres
HBOT je dokazal sposobnost lajšanja nevroinflamatornih procesov pri bolnikih s hudo možgansko disfunkcijo. Ima sposobnost znižanja ravni provnetnih citokinov (kot so IL-1β, IL-12, TNFα in IFNγ), hkrati pa poveča raven protivnetnih citokinov (kot je IL-10). Nekateri raziskovalci menijo, da reaktivne kisikove vrste (ROS), ki jih ustvarja HBOT, posredujejo pri več koristnih učinkih terapije. Posledično so pozitivni rezultati, povezani s HBOT, poleg od tlaka odvisnega delovanja na zmanjšanje mehurčkov in doseganja visoke nasičenosti tkiv s kisikom, delno odvisni tudi od fiziološke vloge proizvedenih ROS.
2. Učinki HBOT na apoptozo in nevroprotekcijo
Raziskave so pokazale, da lahko HBOT zmanjša hipokampalno fosforilacijo mitogenom aktivirane proteinske kinaze p38 (MAPK), kar posledično izboljša kognitivne sposobnosti in zmanjša poškodbe hipokampusa. Ugotovljeno je bilo, da tako samostojna HBOT kot v kombinaciji z izvlečkom ginka bilobe znižujeta izražanje Bax in aktivnost kaspaze-9/3, kar ima za posledico zmanjšano stopnjo apoptoze pri glodavcih, ki jo inducira aβ25-35. Poleg tega je druga študija pokazala, da je predkondicioniranje HBOT povzročilo toleranco proti možganski ishemiji, z mehanizmi, ki vključujejo povečano izražanje SIRT1, skupaj s povečanimi ravnmi B-celičnega limfoma 2 (Bcl-2) in zmanjšano aktivno kaspazo-3, kar poudarja nevroprotektivne in antiapoptotične lastnosti HBOT.
3. Vpliv HBOT na krvni obtok inNevrogeneza
Izpostavljenost oseb HBOT je bila povezana z več učinki na kranialni žilni sistem, vključno s povečanjem prepustnosti krvno-možganske pregrade, spodbujanjem angiogeneze in zmanjšanjem edema. Poleg zagotavljanja večje oskrbe tkiv s kisikom HBOTspodbuja nastanek žilz aktiviranjem transkripcijskih faktorjev, kot je rastni faktor žilnega endotelija, in s spodbujanjem proliferacije živčnih matičnih celic.
4. Epigenetski učinki HBOT
Študije so pokazale, da izpostavljenost človeških mikrovaskularnih endotelijskih celic (HMEC-1) hiperbaričnemu kisiku pomembno uravnava 8101 genov, vključno s povečano in zmanjšano ekspresijo, kar poudarja povečano izražanje genov, povezano s potmi antioksidativnega odziva.
Zaključek
Uporaba HBOT je sčasoma dosegla pomemben napredek, kar dokazuje njeno dostopnost, zanesljivost in varnost v klinični praksi. Čeprav je bila HBOT raziskana kot zdravljenje zunaj indikacij za nevrodestruktivne motnje in so bile izvedene nekatere raziskave, še vedno obstaja nujna potreba po strogih študijah za standardizacijo praks HBOT pri zdravljenju teh stanj. Nadaljnje raziskave so bistvene za določitev optimalne pogostosti zdravljenja in oceno obsega koristnih učinkov za bolnike.
Skratka, preplet hiperbarične oksigenacije in nevrodegenerativnih bolezni kaže na obetavno mejo terapevtskih možnosti, kar upravičuje nadaljnje raziskovanje in potrjevanje v kliničnih okoljih.
Čas objave: 16. maj 2025

